BioNTech-Powerhouse für Immuntherapien des 21. Jahrhunderts
In den letzten Jahren wurde viel über die Pipeline von BioNTech diskutiert, aber nach wie vor scheint ein Großteil der Investierten und auch Interessierten nicht zu verstehen, welche Ansätze BioNTech verfolgt. Im Mittelpunkt der Forschungsarbeit steht nicht eine einzelne Technologie, sondern die Kombination verschiedener Produktkandidaten über verschiedene Wirkstoffklassen hinweg. Dieser koordinierte und synergetische Ansatz soll einen Paradigmenwechsel hin zu individualisierten Immuntherapien einläuten. Das Mainzer Biotech soll sich in den kommenden Jahren zum „Powerhouse für Immuntherapien des 21. Jahrhunderts“(Quelle) entwickeln.
Die klassische Krebstherapie bestand bis vor wenigen Jahren aus folgenden zentralen Säulen:
- Operation
- Bestrahlung
- Chemotherapie
In den letzten 30 Jahren hat sich mit der Immuntherapie eine weitere Therapieform etabliert.
1. Unterschiede zwischen Chemo- und Immuntherapie
Die Ursprünge der Chemotherapie gehen auf den Mediziner Paul Ehrlich zur Behandlung von Syphilis zurück. In der Krebsmedizin wird darunter die Behandlung von bösartigen Tumoren mit chemischen Substanzen, sog. Zytostatika, verstanden. Diese Arzneistoffe sollen die Vermehrung und Teilung von Tumorzellen aufhalten. Im Gegensatz zu einer Operation oder Bestrahlung wird hiermit eine systematische Behandlung ermöglicht. Anders als zielgerichtete Therapieformen wirken Zytostaika damit relativ unspezifisch. Dies ermöglicht es im Gegensatz zu lokal wirkenden Therapiemöglichkeiten auch Krebserkrankungen in fortgeschrittenen Stadien, in denen sich bereits Metastasen gebildet haben, zu behandeln. Dadurch werden jedoch auch gesunde teilungsaktive Zellen, wie etwa des Blut- und Immunsystems, Haut-, Schleimhaut- und Haarzellen, angegriffen.
Bei den Immuntherapien gibt es verschiedene Ansätze, die jedoch alle darauf abzielen das körpereigene Abwehrsystem zu nutzen. In Deutschland wurde 2011 mit dem Checkpoint-Inhibator Ipilimumab (Handelsname Yervoy) die erste Immuntherapie für die Behandlung von schwarzem Hautkrebs zugelassen. Zu den Behandlungsverfahren und Anwendungen zählen unter anderem:
- Checkpoint-Immunmodulatoren
- CAR-T-Zell-Therapie
- Tumorzell-gerichtete Antikörper
- Krebsimpfungen
Vor allem der individuelle patientenzentrierte Ansatz spielt bei der Forschung an neuen Immuntherapien eine immer größer werdende Rolle. Mit diesen Behandlungsoptionen kommt die Medizin dem Ziel näher, viele Krebserkrankungen mit einer potenziell tödlichen Verlaufsform zu chronischen Erkrankungen zu überführen.
2. Chancen und Marktpotenzial für BioNTech
BioNTech verfolgt mit der Kombination verschiedener therapeutischer Plattformen und Bioinformatik- Tools einen einzigartigen Ansatz. Als Aktionär steht natürlich immer die Frage nach potenziellen behördlichen Zulassungen im Raum.
Hierzu lassen zunächst einige Hinweise in öffentlichen Aussagen und Veröffentlichungen finden.
Uğur Şahin: "Unser Plan ist es, bis Ende 2024 zehn oder mehr potenziell zulassungsrelevante Studien in unserer Pipeline zu haben."(Quelle)
Ein Produktkandidat erreicht mit dem Übergang in die abschließende Phase 3 die zulassungsrelevante Studienphase. Aktuell haben mit BNT316 / ONC-392 (Immun-Checkpoint Inhibitor) und BNT323 / DB-1303 (Antikörper-Wirkstoff-Konjugate) zwei Produktkandidaten im Onkologiebereich diese Stadium erreicht. Dazu kommen mit BNT161 (Influenza) und BNT162b2+BNT161 (Kombination Covid+Influenza) zwei Impfstoffe aus dem Bereich der Atemwegserkrankungen.
Es gibt die Möglichkeit eines beschleunigtes Zulassungsverfahren (accelerated approval). Hierfür sind neben der Bedeutung der Therapie für die Allgemeinheit weitere Voraussetzungen zu erfüllen:
- Abschließende Studienphase 3 muss als sog. Kontrollstudie annährend vollständig mit Probanden besetzt sein. Wichtige Hinweise liefern hierzu Seiten wie clinicaltrials.gov. Eine Zulassung ohne Besetzung der Kontrollstudie mit Studienteilnehmern (enrollment) ist nahezu ausgeschlossen.
- Der Sponsor der Studie sollte bereit sein, den Produktkandidaten kommerziell produzieren und vertreiben zu können. Hierzu gibt uns Uğur Şahin einen weiteren Hinweis: „Der Aufbau kommerzieller Kapazitäten zur Vorbereitung auf Produkteinführungen soll Ende 2025 abgeschlossen sein.“(Quelle)
Conclusio: Die Chancen für eine erste behördliche Zulassung einer Immuntherapie scheint für den fortgeschrittenen Produktkandidaten BNT316 / ONC-392 (clinicaltrials.gov: NCT06018337) in der zweiten Jahreshälfte 2025 also durchaus realistisch.
3. Marktpotenzial von BNT316 / ONC-392
Beim Produktkandidaten BNT316 / ONC-392 handelt es sich um einen Checkpoint-Immunmodulator. Krebszellen können Signale aussenden, die die Immunabwehr ausbremsen. Hierbei wird auch von einer sog. Immunevasion gesprochen. Die Checkpoint-Inhibitoren setzen gezielt am Oberflächenmolekül CTLA-4 an, das auch als Kontrollpunkt bzw. Ceckpoint bezeichnet wird. Hierdurch werden die Signale der Krebszellen blockiert und die köpereigene Immunabwehr wieder aktiviert.
Neben dem Lungenkarzinom sind mögliche weitere Anwendungsfelder:
- Schwarzer Hautkrebs
- Leberzellkarzinom
- Nierenzellkarzinom
Das Marktpotenzial wird bei Lungenkrebstherapien bis zum Jahr 2032 auf insgesamt € 55 Milliarden geschätzt. BioNTech zielt mit seinem Kollaborationspartner Onco4 mit BNT316 / ONC-392 auf das nicht-kleinzellige Lungenkarzinom ab. Neue Behandlungschancen ergeben sich hiermit vor allem für Patienten, bei denen durch Therapiealternativen wie Keytruda or Opdivo nicht der gewünschte Behandlungserfolg erreicht werden konnte.
3.1 Behandlungskosten
- Die Behandlungskosten sind hier mit € 100.000 jährlich (Übergang in chronische Krankheit) anzusetzen. (Quelle)
4. Marktpotenzial von BNT323 / DB-1303
Mit BNT323 / DB-1303 (clinicaltrials.gov:NCT06018337) ist ein weiterer Produktkandidat vor wenigen Tagen in die letzte Studienphase übergegangen. Hier soll durch eine Kombination von zwei Behandlungsansätzen das Nebenwirkungsprofil herkömmlicher Therapien reduziert werden. Weiterhin ergeben sich hierdurch neue Möglichkeiten bei der Hintereinanderschaltung von verschiedenen Therapieansätzen. Diese sog. Antikörper-Wirkstoff-Konjugarte (ADCs) transportieren dabei den chemotherapeutischen Wirkstoff zielgerichtet an die dafür bestimmten Tumorzellen.
BNT323 / DB-1303 nutzt das HER2-Protein um die Krebszelle zu identifizieren und an diese anzudocken. Bisher gibt es bei den ADCs drei zugelassene Substanzen für die Behandlung von Brustkrebspatientinnen und diese haben sich mittlerweile zu einem Behandlungsstandard entwickelt. Der Markt für ACDs könnte laut einer Schätzung der Marktanalysten von Evaluate auf bis zu € 28 Milliarden anwachsen. In den vergangenen Jahren sind hier besonders die großen Pharmaunternehmen wie Astrazeneca, Merck oder GSK durch Übernahmen und Lizenzvereinbarungen im ADC Bereich aufgefallen. Experten sehen hier großes Wachstumspotenzial.
4.1 Behandlungskosten:
- Die Behandlungskosten liegen bei vergleichbaren ACDs wie Trastuzumab-Deruxtecan bei ca. € 50.000 bis 150.000 für einen vollständigen Behandlungsdurchgang (Quelle).
5. Großes Marktpotenzial bei den Car-T-Zellen-Therapien
CAR steht für die Abkürzung chimärer Antigenrezeptor. Dieser Antigenrezeptor wird aus unterschiedlichen Bestandteilen zusammengesetzt, die eigentlich nicht zusammengehören – das bezeichnet man als Chimäre. Der CAR wird in T-Zellen integriert und gelangt auf deren Oberfläche. Er hat eine bestimmte Zielstruktur auf den Tumorzellen im Visier, an die er andockt. Dadurch wird die T-Zelle stimuliert, um die Tumorzellen zum Absterben zu bringen. Hier ist eine besonders hohe Ansprechrate von 80-90 Prozent möglich. Bisher gibt es hier vor allem Fortschritte bei den hämatologischen Tumorformen. BioNTech hat jedoch auch zu soliden Tumoren bereits positive Daten im Rahmen einer Phase 1/2 Studie von BNT211 veröffentlicht (Quelle).
Sollten sich diese Daten in weiteren Datenauslesen bestätigen, besteht auch hier ernormes Marktpotenzial für die Behandlung von soliden Tumoren.
5.1 Behandlungskosten:
- Kosten für eine solche einmalige Behandlung liegen bei ca. € 400.000. (Quelle)
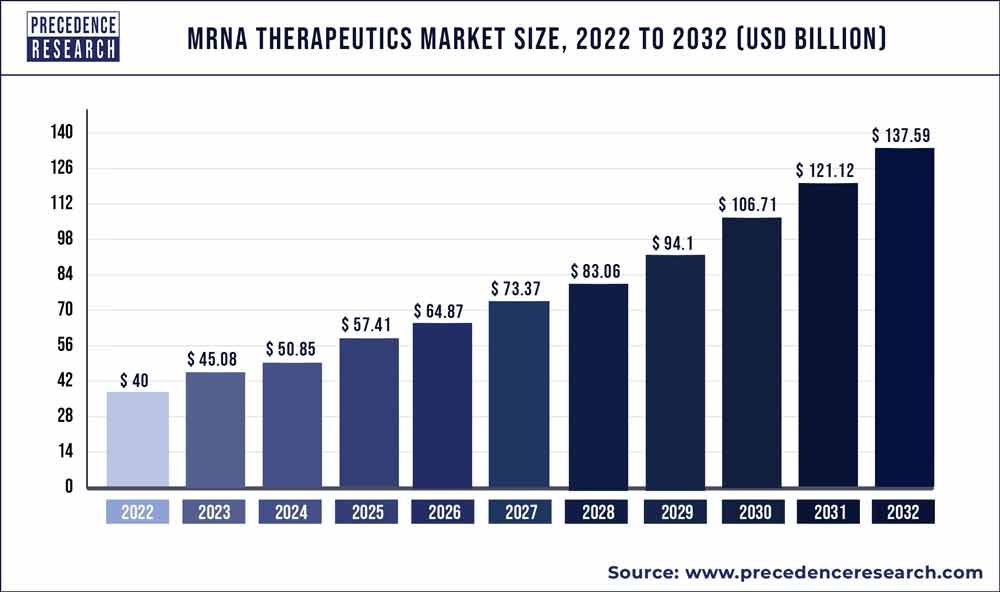
6. Allgemeines Marktpotenzial von mRNA Therapien
Werte zum Blogbeitrag
| Name | Aktuell | Diff. | Börse |
|---|---|---|---|
| Biontech | 84,95 EUR | -0,38 % | Lang & Schwarz |
Disclaimer: Die hier angebotenen Beiträge dienen ausschließlich der Information und stellen keine Kauf- bzw. Verkaufsempfehlungen dar. Sie sind weder explizit noch implizit als Zusicherung einer bestimmten Kursentwicklung der genannten Finanzinstrumente oder als Handlungsaufforderung zu verstehen. Der Erwerb von Wertpapieren birgt Risiken, die zum Totalverlust des eingesetzten Kapitals führen können. Die Informationen ersetzen keine, auf die individuellen Bedürfnisse ausgerichtete, fachkundige Anlageberatung. Eine Haftung oder Garantie für die Aktualität, Richtigkeit, Angemessenheit und Vollständigkeit der zur Verfügung gestellten Informationen sowie für Vermögensschäden wird weder ausdrücklich noch stillschweigend übernommen. Die Markets Inside Media GmbH hat auf die veröffentlichten Inhalte keinerlei Einfluss und vor Veröffentlichung der Beiträge keine Kenntnis über Inhalt und Gegenstand dieser. Die Veröffentlichung der namentlich gekennzeichneten Beiträge erfolgt eigenverantwortlich durch Autoren wie z.B. Gastkommentatoren, Nachrichtenagenturen, Unternehmen. Infolgedessen können die Inhalte der Beiträge auch nicht von Anlageinteressen der Markets Inside Media GmbH und/oder seinen Mitarbeitern oder Organen bestimmt sein. Die Gastkommentatoren, Nachrichtenagenturen, Unternehmen gehören nicht der Redaktion der Markets Inside Media GmbH an. Ihre Meinungen spiegeln nicht notwendigerweise die Meinungen und Auffassungen der Markets Inside Media GmbH und deren Mitarbeiter wieder. Ausführlicher Disclaimer